指導教員

盆子原 誠 -BONKOBARA Makoto- |
|||||
| 学位 | : | 博士(獣医学)(東京大学) | |||
| 職位 | : | 教授 | |||
| 場所 | : | D棟2階 獣医臨床病理学研究室 | |||
| : | bonkobara(@mark)nvlu.ac.jp | ||||
| researchmap | : | 1000365146 | |||
| KAKEN研究者番号 | : | 50343611 | |||
主たる研究テーマ |
|||||
| 伴侶動物の悪性腫瘍に対する分子標的治療の開発と臨床応用 | |||||
研究キーワード |
|||||
| 悪性腫瘍・細胞生物学・分子生物学・シグナル伝達・チロシンキナーゼ | |||||
研究内容 |
|||||
研究内容
▼ 特色ある研究プロジェクト採択課題の動画
伴侶動物の悪性腫瘍に対する分子標的治療に関して、様々な視点から研究を行ってきました。現在は主に、1) チロシンキナーゼ(TK)阻害剤耐性を獲得した犬の肥満細胞腫に対する克服戦略の構築と、2) 犬の扁平上皮癌に対する分子標的治療の開発をテーマとして研究を進めています。
1)TK阻害剤耐性を獲得した犬の肥満細胞腫に対する克服戦略の構築
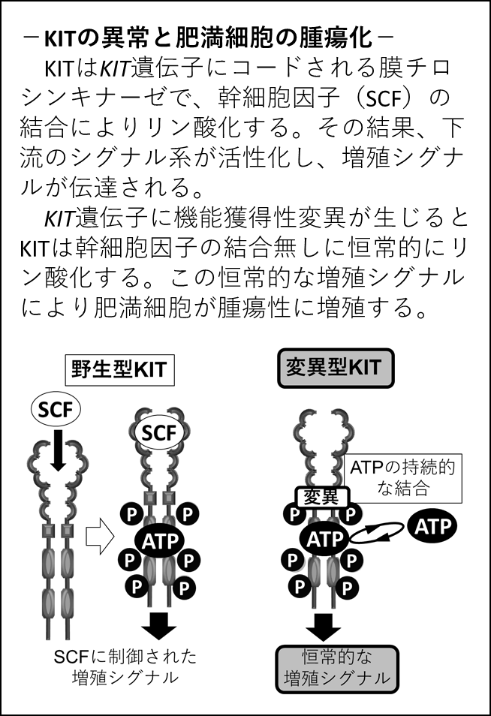
犬の肥満細胞腫は主に皮膚に発生する悪性腫瘍です。発生頻度が非常に高く、臨床上きわめて重要な腫瘍です。一般的に手術・放射線療法が治療の主軸となりますが、状況により抗がん剤やTK阻害剤が用いられます。犬の肥満細胞腫では約30%の症例でKIT遺伝子に機能獲得性変異(右図)が認められます。腫瘍細胞がKIT遺伝子に機能獲得性変異を持つと、多くの場合KITを標的としたTK阻害剤が奏功します。一方、TK阻害剤による治療では、治療経過とともに腫瘍細胞が耐性を獲得し、最終的にほとんどの症例において腫瘍は制御不能となります。
これまで肥満細胞腫のTK阻害剤耐性化について、当教室の研究から:
① KIT遺伝子に二次変異が生じ、KIT蛋白が再活性化する
② KITの側副シグナルが活性化し、増殖シグナルが下流に伝達される
③ KITのユビキチン化の低下によりKITが過剰発現し、増殖シグナルが増強される
④ 超微量のTK阻害剤耐性クローンが予め存在し、これがTK阻害剤存在下で増殖する
と言ったメカニズムが存在することが明らかになりました。
このように、腫瘍細胞は様々な分子機構を動員することでKITを質的あるいは量的に変化させてTK阻害剤の作用を回避し、最終的にTK阻害剤に対して耐性を獲得します。この問題を克服するため、現在、KITの下流シグナル伝達系の調節因子SHP2を標的として新たな治療戦略の構築を試みています。まだまだ道半ばですが、この研究がうまく進めば、肥満細胞腫のTK阻害剤耐性に対して新たな対抗手段が構築できるかもしれません。
2)犬の扁平上皮癌に対する分子標的治療の開発
犬の扁平上皮癌は、皮膚、口腔内、鼻腔内、扁桃などに発生する悪性腫瘍です。一般的に手術や手術と放射線治療の組み合わせが治療の主軸となりますが、切除が難しい状況や転移があるなどの状況では治療が難しくなります。このような状況の扁平上皮癌に対する新たな治療法として、分子標的治療の開発を進めています。
これまでの当教室の研究により、犬の扁平上皮癌では:
① survivinが過剰発現している場合があり、そのような癌細胞ではsurvivin阻害剤によってオートファジーが活性化し細胞死が誘導される
② 特定のキナーゼが増殖の鍵になっている場合があり、そのような癌細胞では特定のTK阻害剤によって細胞死が誘導される
③ 細胞周期の制御分子に異常を持つ場合があり、そのような癌細胞では細胞周期を標的とした分子標的薬によって細胞死が誘導される
と言った事を見出してきました。
しかしながら、これらのメカニズムについてはまだまだ不明な点が多く存在します。また、これらは主にin vitroあるいはマウスモデルを用いたin vivoでの発見であり、これらのメカニズムが実際の症例に存在するのか、存在するなら治療標的としてどれだけ期待できるのか、治療の個別化はどうするのかと言ったことも検討する必要があります。臨床応用に至る道のりはまだまだ長いと考えていますが、新たな治療の開発には地道な研究を一歩ずつ進めて行くしかないと考えています。
3)その他
その他、犬の組織球性肉腫や猫の骨髄腫関連疾患などに対する分子標的治療についても研究を行っています。
指導教員

田村 恭一 -TAMURA Kyoichi- |
|||||
| 学位 | : | 博士(獣医学) | |||
| 職位 | : | 講師 | |||
| 場所 | : | D棟2階 獣医臨床病理学研究室 | |||
| : | ktamura(@mark)nvlu.ac.jp | ||||
| researchmap | : | B000251092 | |||
| KAKEN研究者番号 | : | 00722282 | |||
主たる研究テーマ |
|||||
| 伴侶動物の悪性腫瘍における免疫抑制機構を標的とした治療の開発と臨床応用 | |||||
研究キーワード |
|||||
| 悪性腫瘍・細胞生物学・分子生物学・免疫逃避・がん免疫療法 | |||||
研究内容 |
|||||
研究内容
▼ 特色ある研究プロジェクト採択課題の動画
マウスモデルや伴侶動物の臨床サンプルを用いて一貫してがんの免疫抑制機構に関連した研究活動を行ってきました。現在は悪性腫瘍罹患犬の免疫逃避に重要な役割を担っている骨髄由来免疫抑制細胞を標的とした免疫療法の開発をテーマとして研究を進めています。これまでの研究で、悪性腫瘍罹患犬では健常犬に比べ末梢血中の骨髄由来免疫抑制細胞の割合が明らかに増加しており、さらに進行症例ではより顕著に増加していることを明らかにしました。このことから、悪性腫瘍罹患犬における免疫抑制状態には骨髄由来免疫抑制細胞が重要な役割を担っている可能性が高いと考えられます。そこで現在は、悪性腫瘍罹患犬における骨髄由来免疫抑制細胞の免疫抑制機能を制御する新規がん治療法を確立するために、悪性腫瘍罹患犬における骨髄由来免疫抑制細胞の詳細な機能解析とその免疫抑制機能を制御できる薬剤の探索を進めています。
指導方針
これまで私(盆子原)は指導教授あるいは実質的な指導教員として10名の大学院生の研究を指導してきました。大学院生は皆さんそれぞれ異なる個性と特性を持ち合わせていますので、できるだけそれぞれの特徴に合った指導を行うよう心掛けています。例えば、自らどんどんアイディアを出してゴリゴリ研究を進めたいタイプの大学院生に対しては、もちろん要所要所で状況確認はしますが、できるだけ自由に実験を進めさせるようにしています。一方、慎重で心配性な大学院生に対しては、できるだけこまめにミーティングを行い、その都度結果の確認や次のステップの話し合いを行うようにしています。また、全ての大学院生について、ある程度実験結果がまとまった段階で学会発表をするよう指導しています。学会発表を通して、プレゼンテーションスキルや質疑応答の能力を鍛えるようにしています。
上述のように大学院生とは個別にミーティングを行いますが、週に1回のペースで大学院生と獣医臨床病理学教室の田村講師を交えた大学院生ゼミも行います。これは個別のミーティングとは異なり、基本的に英語で行います。私も田村講師も英語は全く得意ではありませんが、両者ともUniversity of Texas Southwestern Medical Centerで研究者として働いた経験があり、研究者にとって英語でのコミュニケーションがいかに大切か身にしみて痛感しています。そのような経験を踏まえ、大学院生には少しでも英語でのディスカッションに馴染んでもらい、将来、臆することなく海外に出て行き挑戦して欲しいと考えています。また同様の考えで、大学院生には国際学会で口頭発表することを後押ししています。もちろん口頭に選ばれずポスターになってしまうこともありますが、まずは英語の口頭発表に挑戦してもらうようにしています。
大学院生の学術振興会特別研究員採択実績
DC1:2名
DC2:3名
大学院生の卒業後の進路
大学教員:5名(2名は学位取得後にテキサス大学を経て国内大学教員)
民間企業:3名
大学研究員:1名
動物病院:1名
主な学術論文
| ■ 大学院生の筆頭学術論文 | |
| 1. |
Canine intestinal mast cell tumor with c-kit exon 8 mutation responsive to imatinib therapy Kobayashi M, Sugisaki O, Ishii N, Yamada O, Ito K, Kuroki S, Sasaki Y, Ono K, Washizu T, Bonkobara M. (2012) Vet J, 193(1):264-7. DOI: 10.1016/j.tvjl.2011.10.027 |
| 2. |
Identification of dasatinib as an in vitro potent growth inhibitor of canine histiocytic sarcoma cells Ito K, Kuroki S, Kobayashi M, Ono K, Washizu T, Bonkobara M. (2013) Vet J, 196(3):536-40. DOI: 10.1016/j.tvjl.2012.12.016 |
| 3. |
Imatinib-associated tumour response in a dog with a non-resectable gastrointestinal stromal tumour harbouring a c-kit exon 11 deletion mutation Kobayashi M, Kuroki S, Ito K, Yasuda A, Sawada H, Ono K, Washizu T, Bonkobara M. (2013) Vet J, 198(1):271-4. DOI: 10.1016/j.tvjl.2013.05.035 |
| 4. |
The proteasome inhibitor bortezomib inhibits the growth of canine malignant melanoma cells in vitro and in vivo Ito K, Kobayashi M, Kuroki S, Sasaki Y, Iwata T, Mori K, Kuroki T, Ozawa Y, Tetsuka M, Nakagawa T, Hiroi T, Yamamoto H, Ono K, Washizu T, Bonkobara M. (2013) Vet J, 198(3):577-82. DOI: 10.1016/j.tvjl.2013.08.003 |
| 5. |
Molecular changes associated with the development of resistance to imatinib in an imatinib-sensitive canine neoplastic mast cell line carrying a KIT c.1523A>T mutation Kobayashi M, Kuroki S, Tanaka Y, Moriya Y, Kozutumi Y, Uehara Y, Ono K, Tamura K, Washizu T, Bonkobara M. (2015) Eur J Haematol, 95(6):524-31. DOI: 10.1111/ejh.12526 |
| 6. |
Selective growth inhibition by suppression of F1Fo ATPase in canine malignant melanoma cell lines Kuroki S, Kobayashi M, Tani H, Miyamoto R, Kurita S, Tamura K, Ono K, Washizu T, Bonkobara M. (20) J Vet Pharmacol Ther, 40(1):101-104. DOI: 10.1111/jvp.12336 |
| 7. |
A decrease in ubiquitination and resulting prolonged life-span of KIT underlies the KIT overexpression-mediated imatinib resistance of KIT mutation-driven canine mast cell tumor cells Kobayashi M, Kuroki S, Kurita S, Miyamoto R, Tani H, Tamura K, Bonkobara M. (2017) Oncol Rep, 38(4):2543-2550. DOI: 10.3892/or.2017.5865 |
| 8. |
Effect of dasatinib in a xenograft mouse model of canine histiocytic sarcoma and in vitro expression status of its potential target EPHA2 Ito K, Miyamoto R, Tani H, Kurita S, Kobayashi M, Tamura K, Bonkobara M. (2018) J Vet Pharmacol Ther, 41(1):e45-e48. DOI: 10.1111/jvp.12449. Epub 2017 Aug 17 |
| 9. |
Establishment and characterization of a cell line from a feline histiocytic sarcoma Miyamoto R, Kurita S, Tani H, Kobayashi M, Sugiura S, Shigihara K, Sato Y, Tanaka Y, Tamura K, Bonkobara M. (2018) Vet Immunol Immunopathol, 201:72-76. DOI: 10.1016/j.vetimm.2018.05.011 |
| 10. |
Canine squamous cell carcinoma cell lines with high expression of survivin are sensitive to survivin inhibitor YM155. M Miyamoto R, Kurita S, Tani H, Ikeda T, Ishizaka M, Saima H, Kobayashi M, Tamura K, Bonkobara. (2018) Vet J, 240:31-36. DOI: 10.1016/j.tvjl.2018.09.001 |
| 11. |
Genetic alterations of KIT during clonal expansion and subsequent acquisition of resistance to toceranib in a canine mast cell tumor cell line Kurita S, Miyamoto R, Tani H, Kobayashi M, Sasaki T, Tamura K, Bonkobara M. (2019) J Vet Pharmacol Ther, 42(6):673-681. DOI: 10.1111/jvp.12816 |
| 12. |
Nimustine Treatment of 11 Cases of Canine Histiocytic Sarcoma Tani H, Kurita S, Miyamoto R, Sawada H, Fujiwara-Igarashi A, Michishita M, Azakami D, Hasegawa D, Tamura K, Bonkobara M. (2020) J Am Anim Hosp Assoc, 56(3):146. DOI: 10.5326/JAAHA-MS-6959 |
| 13. |
Canine histiocytic sarcoma cell lines with SHP2 p.Glu76Gln or p.Glu76Ala mutations are sensitive to allosteric SHP2 inhibitor SHP099 Tani H, Kurita S, Miyamoto R, Ochiai K, Tamura K, Bonkobara M. (2020) Vet Comp Oncol, 18(2):161-168. DOI: 10.1111/vco.12524 【ジャーナルの表紙に選ばれました】  Veterinary and Comparative Oncology: Volume 18, Issue 2 Pages: 141-255 June 2020. |
| 14. |
A canine case of malignant melanoma carrying a KIT c.1725_1733del mutation treated with toceranib: a case report and in vitro analysis Tani H, Miyamoto R, Noguchi S, Kurita S, Nagashima T, Michishita M, Yayoshi N, Tamura K, Bonkobara M. (2021) BMC Vet Res, 17(1):147. DOI: 10.1186/s12917-021-02864-3 |
| 15. |
Commitment toward cell death by activation of autophagy with survivin inhibitor YM155 in two canine squamous cell carcinoma cell lines with high expression of survivin Miyamoto R, Tani H, Ikeda T, Saima H, Tamura K, Bonkobara M. (2021) Res Vet Sci, 135:412-415. DOI: 10.1016/j.rvsc.2020.10.025 |
| 16. |
A feline case of multiple myeloma treated with bortezomib Tani H, Miyamoto R, Miyazaki T, Oniki S, Tamura K, Bonkobara M. (2022) BMC Vet Res, 18(1):384. DOI: 10.1186/s12917-022-03484-1 |
| 17. |
Molecular characterization of canine SHP2 mutants and anti-tumour effect of SHP2 inhibitor, SHP099, in a xenograft mouse model of canine histiocytic sarcoma Tani H, Miyamoto R, Nagashima T, Michishita M, Tamura K, Bonkobara M. (2022). Vet Comp Oncol, 20(1):109-117. DOI: 10.1111/vco.12751 |
■ Review・Editorial |
|
| 1. |
Dysregulation of tyrosine kinases and use of imatinib in small animal practice Bonkobara M. (2015) Vet J, 205(2):180-8. DOI: 10.1016/j.tvjl.2014.12.015 |
| 2. |
Receptor tyrosine kinase KIT: Prognostic and therapeutic involvement in canine mast cell tumours Takeuchi Y, Bonkobara M. (2016) Vet J, 210:5-6. DOI: 10.1016/j.tvjl.2015.07.012 |
| 3. |
Recent developments in veterinary diagnostics: Current status and future potential Bonkobara M. (2016) Vet J, 215:1-2. DOI: 10.1016/j.tvjl.2016.08.010 |
■ Editor |
|
| 1. |
Editor of Special Issue: Recent Developments in Veterinary Diagnostics Bonkobara M. (2016) The Veterinary Journal, Vol 215. |
■ 共同研究 |
|
| 1. |
Polymorphisms of canine BRCA2 BRC repeats affecting interaction with RAD51 Ochiai K, Ishiguro-Oonuma T, Yoshikawa Y, Udagawa C, Kato Y, Watanabe M, Bonkobara M, Morimatsu M, Omi T. (2015) Biomed Res, 36(2):155-8 DOI: 10.2220/biomedres.36.155 |
| 2. |
Molecular cloning of canine co-chaperone small glutamine-rich tetratricopeptide repeat-containing protein α (SGTA) and investigation of its ability to suppress androgen receptor signalling in androgen-independent prostate cancer Kato Y, Ochiai K, Michishita M, Azakami D, Nakahira R, Morimatsu M, Ishiguro-Oonuma T, Yoshikawa Y, Kobayashi M, Bonkobara M, Kobayashi M, Takahashi K, Watanabe M, Omi T. (2015) Vet J, 206(2):143-8. DOI: 10.1016/j.tvjl.2015.08.002 |
| 3. |
The canine prostate cancer cell line CHP-1 shows over-expression of the co-chaperone small glutamine-rich tetratricopeptide repeat-containing protein α Azakami D, Nakahira R, Kato Y, Michishita M, Kobayashi M, Onozawa E, Bonkobara M, Kobayashi M, Takahashi K, Watanabe M, Ishioka K, Sako T, Ochiai K, Omi T. (2017) Vet Comp Oncol, 15(2):557-562. DOI: 10.1111/vco.12199 |
| 4. |
Properties of the feline tumour suppressor reduced expression in immortalized cells (REIC/Dkk-3) Ochiai K, Oda H, Shono S, Kato Y, Sugihara S, Nakazawa S, Azakami D, Michishita M, Onozawa E, Bonkobara M, Sako T, Shun-Ai L, Ueki H, Watanabe M, Omi T. (2017) Vet Comp Oncol, 15(4):1181-1186. DOI: 10.1111/vco.12254 |
| 5. |
Molecular Characterization of the Cytidine Monophosphate-N-Acetylneuraminic Acid Hydroxylase (CMAH) Gene Associated with the Feline AB Blood Group System Omi T, Nakazawa S, Udagawa C, Tada N, Ochiai K, Chong YH, Kato Y, Mitsui H, Gin A, Oda H, Azakami D, Tamura K, Sako T, Inagaki T, Sakamoto A, Tsutsui T, Bonkobara M, Tsuchida S, Ikemoto S. (2016) PLoS One, 11(10):e0165000. DOI: 10.1371/journal.pone.0165000 |
| 6. |
Oncocytic carcinoma of the salivary gland in a dog Nakahira R, Michishita M, Kato M, Okuno Y, Hatakeyama H, Yoshimura H, Azakami D, Ochiai K, Bonkobara M, Takahashi K.(2017) J Vet Diagn Invest, 29(1):105-108. DOI: 10.1177/1040638716673126 |
| 7. |
MicroRNA expression profiling in canine prostate cancer Kobayashi M, Saito A, Tanaka Y, Michishita M, Kobayashi M, Irimajiri M, Kaneda T, Ochiai K, Bonkobara M, Takahashi K, Hori T, Kawakami E. (2017) J Vet Med Sci, 79(4):719-725. DOI: 10.1292/jvms.16-0279 |
| 8. |
Canine REIC/Dkk-3 interacts with SGTA and restores androgen receptor signalling in androgen-independent prostate cancer cell lines Kato Y, Ochiai K, Kawakami S, Nakao N, Azakami D, Bonkobara M, Michishita M, Morimatsu M, Watanabe M, Omi T. (2017) BMC Vet Res, 13(1):170. DOI: 10.1186/s12917-017-1094-4 |
| 9. |
Identification of a secondary mutation in the KIT kinase domain correlated with imatinib-resistance in a canine mast cell tumor Nakano Y, Kobayashi M, Bonkobara M, Takanosu M. (2017) Vet Immunol Immunopathol, 188:84-88. DOI: 10.1016/j.vetimm.2017.05.004 |
| 10. |
Anti-tumour activity of oncolytic reovirus against canine histiocytic sarcoma cells Igase M, Shousu K, Fujiki N, Sakurai M, Bonkobara M, Hwang CC, Coffey M, Noguchi S, Nemoto Y, Mizuno T. (2019) Vet Comp Oncol, 17(2):184-193. DOI: 10.1111/vco.12468 |
| 11. |
The secondary KIT mutation p.Ala510Val in a cutaneous mast cell tumour carrying the activating mutation p.Asn508Ile confers resistance to masitinib in dogs Gentilini F, Turba ME, Dally C, Takanosu M, Kurita S, Bonkobara M. (2020) BMC Vet Res, 19;16(1):64. DOI: 10.1186/s12917-020-02284-9 |
| 12. |
Foxp3+ Regulatory T Cells Associated With CCL17/CCR4 Expression in Carcinomas of Dogs Maeda S, Nakazawa M, Uchida M, Yoshitake R, Nakagawa T, Nishimura R, Miyamoto R, Bonkobara M, Yonezawa T, Momoi Y. (2020) Vet Pathol, 57(4):497-506. DOI: 10.1177/0300985820921535 |
| 13. |
Establishment of a BRAF V595E-mutant canine prostate cancer cell line and the antitumor effects of MEK inhibitors against canine prostate cancer Kobayashi M, Onozawa M, Watanabe S, Nagashima T, Tamura K, Kubo Y, Ikeda A, Ochiai K, Michishita M, Bonkobara M, Kobayashi M, Hori T, Kawakami E. (2023) Vet Comp Oncol. DOI: 10.1111/vco.12879 |











